FÍSICO-QUÍMICA
Uma mistura contendo 3250 mL de água e 410 g de sacarose (C12H22O11) foi produzida em um laboratório, com intenção de estudar o
100,89 °C
101,12 °C
101,12 °C
100,19 °C
100,37 °C
O derramamento de óleo que contaminou o litoral nordestino em 2019 provocou prejuizos enormes ao meio ambiente, e à economia da região. Uma parte do óleo, que ficou submersa, está sendo retirada por mergulhadores utilizando cilindros com ar comprimido. Estes cilindros são preenchidos com uma mistura contendo 21% de O2 e 79% de N2. Sabendo que um desses cilindros contém 25 litros de oxigênio, sob pressão de 10 atm e a 25 °C, determine a massa de O2 dentro desse cilindro.
Dados: Massa molar do O2 = 32 g/mol.
195,43 g
550,50 g
1.492 g
327,33 g
118,60 g
As transformações gasosas nos dão uma previsão sobre o comportamento dos gases considerados ideais. Uma lata de refrigerante contém em seu interior gás carbônico. A temperatura de 25 ºC a pressão no interior da lata é de 1,5 atm, qual seria a pressão da lata em um congelador a temperatura de -5 ºC?
Continuaria a mesma pressão, pois o volume é constante
13,5 atm
1,35 atm
16,6 atm
1,66 atm
Em uma lagoa de resíduos industriais, após o descarte de uma grande quantidade de solução aquosa de amônia (NH3). Após certo tempo ocorreu o equilíbrio apresentando 0,0119 mol/L de NH3, 0,000464 mol/L de íon amônio (NH4+) e 0,000646 mol/L de hidroxila (OH-) . Determine o valor da constante de equilíbrio em função da concentração (Kc) para esta reação.
NH3(H2O) <===> NH4+(aq) + OH-(aq)
Kc = 2,5 X 10 -5
Kc = 2,5 X 10 -7
Kc = 1,8 X 10 -5
Kc = 0,5 X 10 -5
Kc = 1,8 X 10 -6
Em algumas situações, é muito fácil medir a pressão de um gás do que medir a sua concentração. No sentido de facilitar o acompanhamento de processos que envolvem gases, propôs-se escrever uma expressão de equilíbrio em função das pressões parciais dos gases presentes no meio reacional que caminha para o equilíbrio químico. Para o equilíbrio 2NOCl(g) <--> 2NO(g) + Cl2(g), o valor da constante de equilíbrio Kc é 3,75 x 10-6 a 796°C. Qual o valor de Kp para esta reação nesta temperatura?
1,94 x 104
3,01 x 10-4
5,17 x 109
3,75 x 10-6
3,29 x 10-4
Em condições apropriadas, a reação N2O5 à N2O4 + ½ O2 ocorre, gerando a tabela de variação na concentração de N2O5 em função do tempo, colocada abaixo:
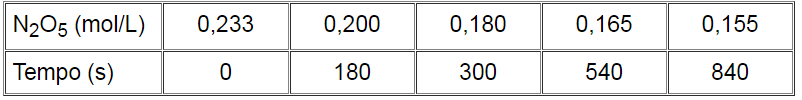
Calcule a velocidade média da reação no intervalo de 3 a 5 min.
0,10 mol/L.min
0,15 mol/L.min
0,50 mol/L.min
0,01 mol/L.min
0,04 mol/L.min
Analisando uma solução aquosa de HCN, que no equilíbrio apresenta 6 x 10 -7 mols/l de HCN e constante de ionização Ka = 10 -7 , determine a concentração de H + no equilíbrio.
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
100,89 °C
101,12 °C
101,12 °C
100,19 °C
100,37 °C
O derramamento de óleo que contaminou o litoral nordestino em 2019 provocou prejuizos enormes ao meio ambiente, e à economia da região. Uma parte do óleo, que ficou submersa, está sendo retirada por mergulhadores utilizando cilindros com ar comprimido. Estes cilindros são preenchidos com uma mistura contendo 21% de O2 e 79% de N2. Sabendo que um desses cilindros contém 25 litros de oxigênio, sob pressão de 10 atm e a 25 °C, determine a massa de O2 dentro desse cilindro.
Dados: Massa molar do O2 = 32 g/mol.
195,43 g
550,50 g
1.492 g
327,33 g
118,60 g
As transformações gasosas nos dão uma previsão sobre o comportamento dos gases considerados ideais. Uma lata de refrigerante contém em seu interior gás carbônico. A temperatura de 25 ºC a pressão no interior da lata é de 1,5 atm, qual seria a pressão da lata em um congelador a temperatura de -5 ºC?
Continuaria a mesma pressão, pois o volume é constante
13,5 atm
1,35 atm
16,6 atm
1,66 atm
Em uma lagoa de resíduos industriais, após o descarte de uma grande quantidade de solução aquosa de amônia (NH3). Após certo tempo ocorreu o equilíbrio apresentando 0,0119 mol/L de NH3, 0,000464 mol/L de íon amônio (NH4+) e 0,000646 mol/L de hidroxila (OH-) . Determine o valor da constante de equilíbrio em função da concentração (Kc) para esta reação.
NH3(H2O) <===> NH4+(aq) + OH-(aq)
Kc = 2,5 X 10 -5
Kc = 2,5 X 10 -7
Kc = 1,8 X 10 -5
Kc = 0,5 X 10 -5
Kc = 1,8 X 10 -6
Em algumas situações, é muito fácil medir a pressão de um gás do que medir a sua concentração. No sentido de facilitar o acompanhamento de processos que envolvem gases, propôs-se escrever uma expressão de equilíbrio em função das pressões parciais dos gases presentes no meio reacional que caminha para o equilíbrio químico. Para o equilíbrio 2NOCl(g) <--> 2NO(g) + Cl2(g), o valor da constante de equilíbrio Kc é 3,75 x 10-6 a 796°C. Qual o valor de Kp para esta reação nesta temperatura?
1,94 x 104
3,01 x 10-4
5,17 x 109
3,75 x 10-6
3,29 x 10-4
Em condições apropriadas, a reação N2O5 à N2O4 + ½ O2 ocorre, gerando a tabela de variação na concentração de N2O5 em função do tempo, colocada abaixo:

Calcule a velocidade média da reação no intervalo de 3 a 5 min.
0,10 mol/L.min
0,15 mol/L.min
0,50 mol/L.min
0,01 mol/L.min
0,04 mol/L.min
Analisando uma solução aquosa de HCN, que no equilíbrio apresenta 6 x 10 -7 mols/l de HCN e constante de ionização Ka = 10 -7 , determine a concentração de H + no equilíbrio.
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
195,43 g
550,50 g
1.492 g
327,33 g
118,60 g
As transformações gasosas nos dão uma previsão sobre o comportamento dos gases considerados ideais. Uma lata de refrigerante contém em seu interior gás carbônico. A temperatura de 25 ºC a pressão no interior da lata é de 1,5 atm, qual seria a pressão da lata em um congelador a temperatura de -5 ºC?
Continuaria a mesma pressão, pois o volume é constante
13,5 atm
1,35 atm
16,6 atm
1,66 atm
Em uma lagoa de resíduos industriais, após o descarte de uma grande quantidade de solução aquosa de amônia (NH3). Após certo tempo ocorreu o equilíbrio apresentando 0,0119 mol/L de NH3, 0,000464 mol/L de íon amônio (NH4+) e 0,000646 mol/L de hidroxila (OH-) . Determine o valor da constante de equilíbrio em função da concentração (Kc) para esta reação.
NH3(H2O) <===> NH4+(aq) + OH-(aq)
Kc = 2,5 X 10 -5
Kc = 2,5 X 10 -7
Kc = 1,8 X 10 -5
Kc = 0,5 X 10 -5
Kc = 1,8 X 10 -6
Em algumas situações, é muito fácil medir a pressão de um gás do que medir a sua concentração. No sentido de facilitar o acompanhamento de processos que envolvem gases, propôs-se escrever uma expressão de equilíbrio em função das pressões parciais dos gases presentes no meio reacional que caminha para o equilíbrio químico. Para o equilíbrio 2NOCl(g) <--> 2NO(g) + Cl2(g), o valor da constante de equilíbrio Kc é 3,75 x 10-6 a 796°C. Qual o valor de Kp para esta reação nesta temperatura?
1,94 x 104
3,01 x 10-4
5,17 x 109
3,75 x 10-6
3,29 x 10-4
Em condições apropriadas, a reação N2O5 à N2O4 + ½ O2 ocorre, gerando a tabela de variação na concentração de N2O5 em função do tempo, colocada abaixo:

Calcule a velocidade média da reação no intervalo de 3 a 5 min.
0,10 mol/L.min
0,15 mol/L.min
0,50 mol/L.min
0,01 mol/L.min
0,04 mol/L.min
Analisando uma solução aquosa de HCN, que no equilíbrio apresenta 6 x 10 -7 mols/l de HCN e constante de ionização Ka = 10 -7 , determine a concentração de H + no equilíbrio.
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
Continuaria a mesma pressão, pois o volume é constante
13,5 atm
1,35 atm
16,6 atm
1,66 atm
Em uma lagoa de resíduos industriais, após o descarte de uma grande quantidade de solução aquosa de amônia (NH3). Após certo tempo ocorreu o equilíbrio apresentando 0,0119 mol/L de NH3, 0,000464 mol/L de íon amônio (NH4+) e 0,000646 mol/L de hidroxila (OH-) . Determine o valor da constante de equilíbrio em função da concentração (Kc) para esta reação.
NH3(H2O) <===> NH4+(aq) + OH-(aq)
Kc = 2,5 X 10 -5
Kc = 2,5 X 10 -7
Kc = 1,8 X 10 -5
Kc = 0,5 X 10 -5
Kc = 1,8 X 10 -6
Em algumas situações, é muito fácil medir a pressão de um gás do que medir a sua concentração. No sentido de facilitar o acompanhamento de processos que envolvem gases, propôs-se escrever uma expressão de equilíbrio em função das pressões parciais dos gases presentes no meio reacional que caminha para o equilíbrio químico. Para o equilíbrio 2NOCl(g) <--> 2NO(g) + Cl2(g), o valor da constante de equilíbrio Kc é 3,75 x 10-6 a 796°C. Qual o valor de Kp para esta reação nesta temperatura?
1,94 x 104
3,01 x 10-4
5,17 x 109
3,75 x 10-6
3,29 x 10-4
Em condições apropriadas, a reação N2O5 à N2O4 + ½ O2 ocorre, gerando a tabela de variação na concentração de N2O5 em função do tempo, colocada abaixo:

Calcule a velocidade média da reação no intervalo de 3 a 5 min.
0,10 mol/L.min
0,15 mol/L.min
0,50 mol/L.min
0,01 mol/L.min
0,04 mol/L.min
Analisando uma solução aquosa de HCN, que no equilíbrio apresenta 6 x 10 -7 mols/l de HCN e constante de ionização Ka = 10 -7 , determine a concentração de H + no equilíbrio.
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
Kc = 2,5 X 10 -5
Kc = 2,5 X 10 -7
Kc = 1,8 X 10 -5
Kc = 0,5 X 10 -5
Kc = 1,8 X 10 -6
Em algumas situações, é muito fácil medir a pressão de um gás do que medir a sua concentração. No sentido de facilitar o acompanhamento de processos que envolvem gases, propôs-se escrever uma expressão de equilíbrio em função das pressões parciais dos gases presentes no meio reacional que caminha para o equilíbrio químico. Para o equilíbrio 2NOCl(g) <--> 2NO(g) + Cl2(g), o valor da constante de equilíbrio Kc é 3,75 x 10-6 a 796°C. Qual o valor de Kp para esta reação nesta temperatura?
1,94 x 104
3,01 x 10-4
5,17 x 109
3,75 x 10-6
3,29 x 10-4
Em condições apropriadas, a reação N2O5 à N2O4 + ½ O2 ocorre, gerando a tabela de variação na concentração de N2O5 em função do tempo, colocada abaixo:

Calcule a velocidade média da reação no intervalo de 3 a 5 min.
0,10 mol/L.min
0,15 mol/L.min
0,50 mol/L.min
0,01 mol/L.min
0,04 mol/L.min
Analisando uma solução aquosa de HCN, que no equilíbrio apresenta 6 x 10 -7 mols/l de HCN e constante de ionização Ka = 10 -7 , determine a concentração de H + no equilíbrio.
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
1,94 x 104
3,01 x 10-4
5,17 x 109
3,75 x 10-6
3,29 x 10-4
Em condições apropriadas, a reação N2O5 à N2O4 + ½ O2 ocorre, gerando a tabela de variação na concentração de N2O5 em função do tempo, colocada abaixo:

Calcule a velocidade média da reação no intervalo de 3 a 5 min.
0,10 mol/L.min
0,15 mol/L.min
0,50 mol/L.min
0,01 mol/L.min
0,04 mol/L.min
Analisando uma solução aquosa de HCN, que no equilíbrio apresenta 6 x 10 -7 mols/l de HCN e constante de ionização Ka = 10 -7 , determine a concentração de H + no equilíbrio.
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?

0,10 mol/L.min
0,15 mol/L.min
0,50 mol/L.min
0,01 mol/L.min
0,04 mol/L.min
Analisando uma solução aquosa de HCN, que no equilíbrio apresenta 6 x 10 -7 mols/l de HCN e constante de ionização Ka = 10 -7 , determine a concentração de H + no equilíbrio.
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
[H+] = 5,1 X 10 -6
[H+] = 4,0 X 10 -4
[H+] = 1,4 X 10 -7
[H+] = 2,4 X 10 -7
[H+] = 1,0 X 10 -7